熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
阿爾茨海默病(Alzheimer's disease,AD),俗稱老年癡呆,是一種以記憶衰退和認知功能進行性下降為特征的神經退行性疾病。隨著人口老齡化,我國AD患者預計到2050年將超過3000萬例,給社會和家庭帶來沉重負擔。科學家發現,這種病可能與大腦中一種叫"β-淀粉樣蛋白"的有害物質堆積[1]以及大腦中多巴胺系統的失調[2-4]有關。但目前醫學界還沒有找到完全治愈的方法。現有的無創腦部電刺激治療雖然有一定效果,但存在兩個主要難題:一是難以精準刺激到大腦深部的關鍵區域,二是無法實時監測腦內化學物質的變化。此外,目前缺乏能夠同時實現精準刺激和監測的微型腦部治療設備。
在微納傳感技術創新研究群體和前沿交叉研判戰略研究聯合等項目支持下,中國科學院空天信息創新研究院(簡稱“中科院空天院”)吳一戎/宋軼琳/蔡新霞團隊在Nature Communications上發表了題為“Integrated dopamine sensing and 40 Hz hippocampal stimulation improves cognitive performance in Alzheimer’s mouse models”的最新研究成果,研發了一種雙模雙向柔性腦機接口神經微電極NeuroRevive-FlexChip。集成多巴胺實時監測、神經電活動記錄和原位電刺激功能,發現了40Hz微電流靶向刺激海馬區后,誘發AD小鼠海馬體神經元多巴胺釋放和微觀神經振蕩,改善AD小鼠認知功能。研究發現,采用NeuroRevive-FlexChip進行40Hz電刺激,會誘發多巴胺水平短暫升高,并呈現刺激結束后短期重啟現象。在重啟期內,神經元放電模式從簇狀放電(burst firing),轉變為持續性放電(tonic firing)。最終,經過治療的AD小鼠在Y迷宮測試中的認知能力增強;微觀神經分子與細胞分析也證實該干預可有效減少Aβ42沉積,并誘導小膠質細胞形態重塑。這一創新性技術實現了電生理-電化學雙模態檢測與神經調控的器件集成,為AD的精準干預和治療靶點尋找提供了技術平臺。該技術有望突破現有AD治療中深部腦區靶向性不足與多模式檢測缺失的技術瓶頸,為阿爾茨海默癥等難治性神經疾病精準治療提供新型腦機接口技術手段,具有重要的科學意義和臨床價值。
1.柔性神經電極NeuroRevive-FlexChip實現多巴胺和神經電活動檢測與電刺激一體化
針對阿爾茨海默病中多巴胺信號紊亂與神經放電異常并存的復雜病理,研究團隊研發了NeuroRevive-FlexChip,這是一款柔性腦機接口神經微電極,首次實現了在小鼠深腦海馬CA1區原位靶向刺激、神經電活動以及多巴胺濃度動態釋放的一體化檢測。該神經微電極采用雙導電層結構設計,包含高空間分辨率的微電極陣列。神經微電極的電生理檢測阻抗低至2~3 kΩ1kHz,多巴胺檢測限達100 nM,檢測靈敏度約為37.54 pA/μM。
圖1深腦靶向刺激改善阿爾茨海默模型小鼠認知功能
2.40Hz電刺激調控誘導多巴胺動態釋放與微觀神經振蕩,揭示神經調控新機制
使用NeuroRevive-FlexChip對APP/PS1小鼠進行海馬CA1區40Hz電刺激后,研究者觀察到一種顯著的“多巴胺重啟現象”:刺激期間多巴胺濃度迅速升高,刺激停止后先下降,隨后又自發回升。這種動力學過程呈現出刺激后多巴胺釋放-回落-再上升的循環,提示存在一個刺激觸發的短時調控回路。
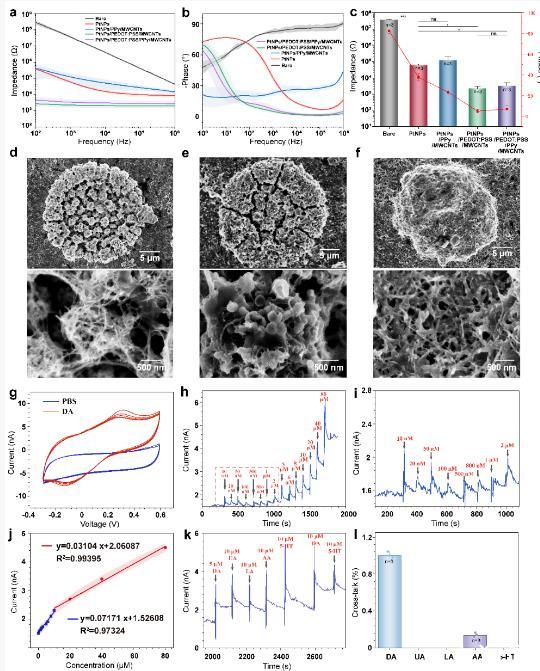
圖2.柔性腦機接口NeuroRevive-FlexChip的神經電活動和多巴胺檢測性能
與多巴胺濃度波動相對應,神經元放電模式也發生了轉換。具體而言,當多巴胺水平下降時,神經元以稀疏、規律的持續性放電(tonic firing)為主;而在多巴胺濃度上升階段,神經元則出現簇狀放電(burst firing)。尤其在300μA刺激強度下,每一個5 s分布的簇中動作電位的平均發放頻率接近8 Hz,而每一個簇中包含40個動作電位,提示神經元可能與刺激信號頻率發生了神經協同效應。這一現象揭示了電刺激—多巴胺釋放—放電模式重構之間的動態反饋機制,首次明確電生理調控可通過多巴胺介導的方式快速重塑神經活動節律。
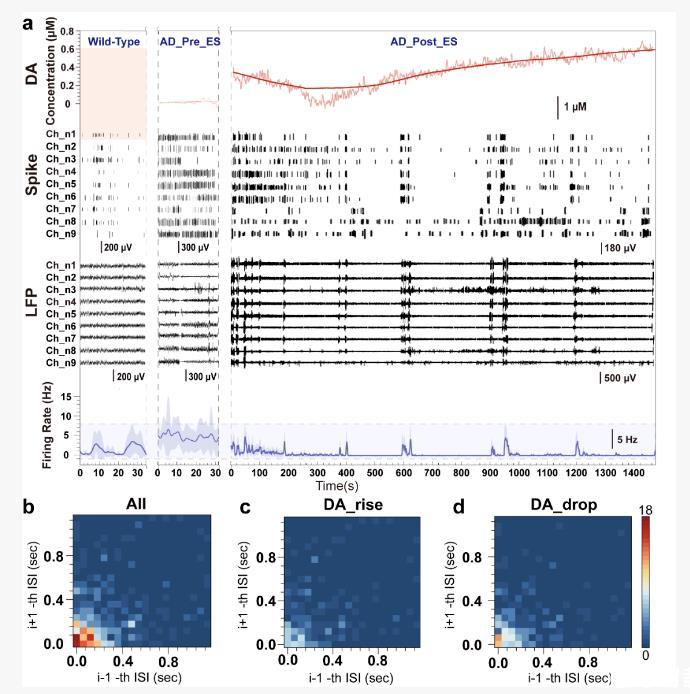
圖3.深腦靶向刺激引起多巴胺釋放和微觀神經振蕩
3.多尺度驗證電刺激改善AD病理的干預效果,建立從行為到分子的完整證據鏈
本研究通過從行為學、細胞電生理、神經遞質水平到組織病理學的多尺度驗證,建立了電刺激調控AD病理機制的完整證據鏈。在宏觀行為層面,APP/PS1模型小鼠在40 Hz刺激后,其Y迷宮自發交替率由刺激前的47%提升至61%,接近野生型水平63%,說明空間工作記憶有所改善。在微觀分子層面,刺激7天后的小鼠海馬CA1和DG區Aβ42斑塊顯著減少,說明40 Hz電刺激可調控與AD核心病理相關的淀粉樣蛋白積累。此外,免疫組織化學顯示刺激后小鼠海馬區小膠質細胞樹突數量、分支長度、末端數量顯著增加,表明其可能在清除Aβ42過程中發揮積極作用。
藥理干預實驗進一步驗證了多巴胺在這一效應鏈條中的中介作用:使用多巴胺D2受體拮抗劑可完全阻斷40 Hz刺激誘導的多巴胺釋放與神經放電改變,而D1/D2激動劑可顯著提升多巴胺水平并誘導burst firing。
綜上,研究首次從電刺激—神經遞質—神經活動—病理改變—行為改善這一完整路徑,系統揭示了40 Hz刺激對AD病理的多層次干預潛力,為AD早期治療提供了新策略和多維證據支持。
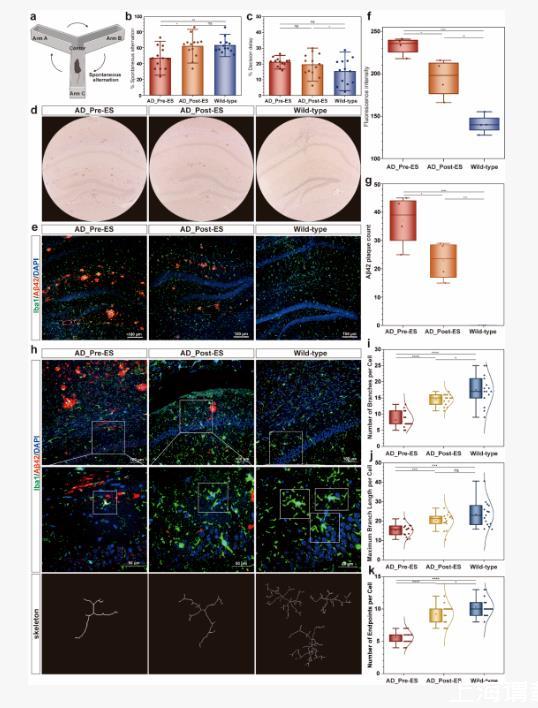
圖4.深腦靶向刺激改善阿爾茨海默模型小鼠認知功能,減少Aβ42斑塊沉積
啟發與展望
本研究通過NeuroRevive-FlexChip首次在阿爾茨海默病模型小鼠中實現了對多巴胺釋放、電生理活動與電刺激效應的多模態協同檢測與調控,系統揭示了40Hz電刺激誘導的神經環路功能重塑機制。研究發現,AD模型小鼠存在異常高頻放電與多巴胺水平下調,40Hz刺激能夠有效提升多巴胺釋放、抑制異常同步放電,并伴隨行為改善與Aβ42負荷下降,構建了從神經活動、神經遞質調控到病理緩解的完整干預鏈條。此外,研究表明神經元放電模式的變化與多巴胺濃度動態呈高度耦合關系,提示刺激頻率與內源性神經節律可能存在功能共振,為理解AD中神經調控節律失衡提供了新視角。該研究不僅驗證了40Hz神經調控的可行性與多層效應,也為多巴胺系統在AD中的作用提供了直接電化學證據。
本工作展示了柔性腦機接口神經微電極在神經退行性疾病研究中的巨大潛力,為實現精準、實時、閉環的神經調控提供了新范式。未來研究可基于此平臺拓展至多遞質(如谷氨酸、GABA、5-HT)聯合檢測,并集成多腦區同步采集與調控,解析更復雜的神經調控網絡。