熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
2.氫處理可抑制膠質(zhì)瘤細(xì)胞的干性
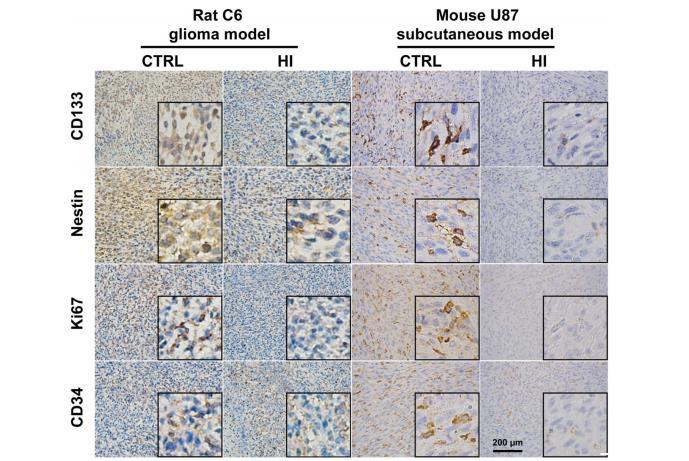
圖2:吸入氫氣后,生物標(biāo)志物的表達(dá)發(fā)生了變化。在大鼠C6膠質(zhì)瘤和小鼠U87皮下模型中,吸入氫氣都會(huì)降低CD133、Nestin、Ki67和CD34的表達(dá)。CTRL:對照組;HI:氫氣吸入組
為了確定分子氫對膠質(zhì)瘤細(xì)胞干性的潛在影響,研究人員在大鼠C6膠質(zhì)瘤和小鼠U87皮下模型中檢測了干性標(biāo)記物的表達(dá)。免疫組化(IHC)染色顯示,在大鼠C6或小鼠U87模型中,與對照組相比,氫氣組CD133和Nestin的表達(dá)明顯下降(圖2)。與對照組相比,HI組Ki67和CD34的表達(dá)也明顯下降(圖2)。
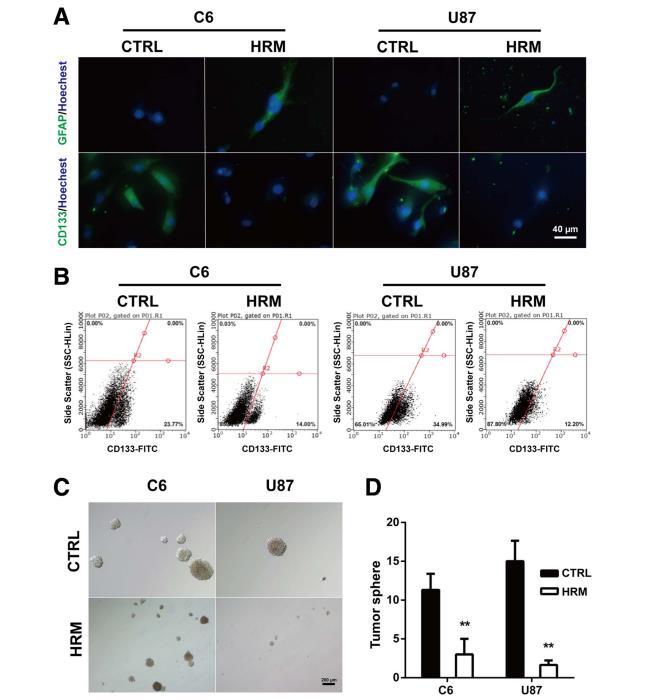
圖3:處理減弱了膠質(zhì)瘤細(xì)胞的干性。氫處理后,用免疫熒光染色法評(píng)估膠質(zhì)瘤細(xì)胞中GFAP和CD133的表達(dá)水平(a)。氫氣處理后,CD133陽性細(xì)胞的數(shù)量用流式細(xì)胞儀測定(b)。膠質(zhì)瘤細(xì)胞的癌干細(xì)胞自我更新能力是通過球形成試驗(yàn)確定的。拍攝的代表性圖像(c)和量化(d)。GFAP,神經(jīng)膠質(zhì)纖維酸性蛋白;CTRL,對照組;HRM,富氫培養(yǎng)基。
為了證實(shí)分子氫對膠質(zhì)瘤細(xì)胞干性的影響,在體外對C6和U87細(xì)胞進(jìn)行了免疫熒光。富氫培養(yǎng)基使C6和U87細(xì)胞的CD133表達(dá)明顯減少(C6,26.08±1.93vs.45.02±3.47,p=0.0088;U87,26.11±3.89vs.51.81±3.09,p=0.0066)。氫處理也增強(qiáng)了兩種細(xì)胞系膠質(zhì)標(biāo)記物GFAP的表達(dá)(C6,64.35±5.69vs.22.87±2.23,p=0.0025;U87,62.45±3.20vs.12.51±1.29,p=0.0066)(圖3a)。
為了進(jìn)一步證實(shí)分子氫對膠質(zhì)瘤細(xì)胞干性的抑制作用,研究人員使用流式細(xì)胞術(shù)測定了C6和U87細(xì)胞中CD133陽性細(xì)胞的比例。與對照組相比,氫處理明顯降低了C6(15.39±0.70vs.24.83±1.30,p=0.0031)和U87(13.70±0.97vs.33.98±0.52,p<0.0001)細(xì)胞中CD133陽性細(xì)胞的比例(圖3b)。為了研究分子氫對膠質(zhì)瘤細(xì)胞癌干細(xì)胞自我更新能力的影響,我們進(jìn)行了球形成試驗(yàn)。如圖3c和d所示,氫處理顯著抑制了膠質(zhì)瘤細(xì)胞的球形成能力,表現(xiàn)為腫瘤球的數(shù)量減少(C6,3.00±1.15vs.11.33±1.20,p=0.0075;U87,1.67±0.33vs.15.00±1.53,p=0.001)和體積變小。
3.氫處理促進(jìn)膠質(zhì)瘤干樣細(xì)胞(GSC)分化
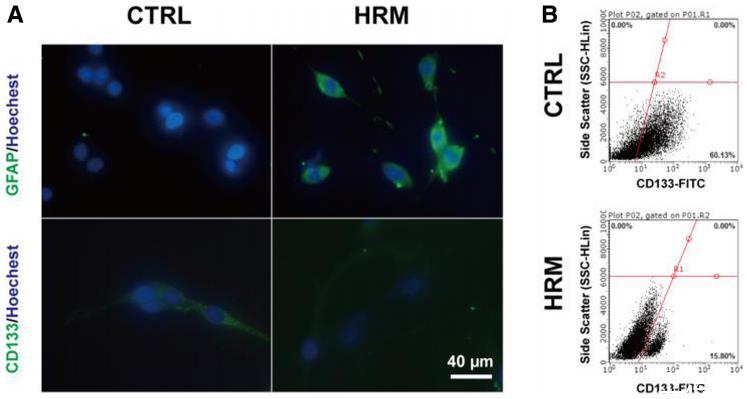
圖4氫處理誘導(dǎo)C6亞球分化。氫氣處理后,用免疫熒光染色法評(píng)估C6亞球中GFAP和CD133的表達(dá)水平(a)。氫氣處理后使用流式細(xì)胞儀測定CD133陽性細(xì)胞的數(shù)量(b)。GFAP:神經(jīng)膠質(zhì)纖維酸性蛋白;CTRL:對照組;HRM:富氫培養(yǎng)基
為了直接確定氫處理對GSCs的影響,進(jìn)行了亞球形成試驗(yàn)和表面標(biāo)記分析。C6細(xì)胞生長形成腫瘤球,原球解離4-5天后形成子球。免疫熒光結(jié)果顯示,氫處理明顯增加了GFAP的表達(dá)(58.13±6.63vs.18.60±1.79,p=0.0045),并顯著下調(diào)了CD133的表達(dá)(13.43±2.46vs.32.34±6.14,p=0.046)(圖4a)。流式細(xì)胞術(shù)分析表明,氫處理組CD133陽性細(xì)胞數(shù)量明顯減少(圖4b)。
4.氫處理可抑制膠質(zhì)瘤細(xì)胞的遷移、侵襲和集落形成能力
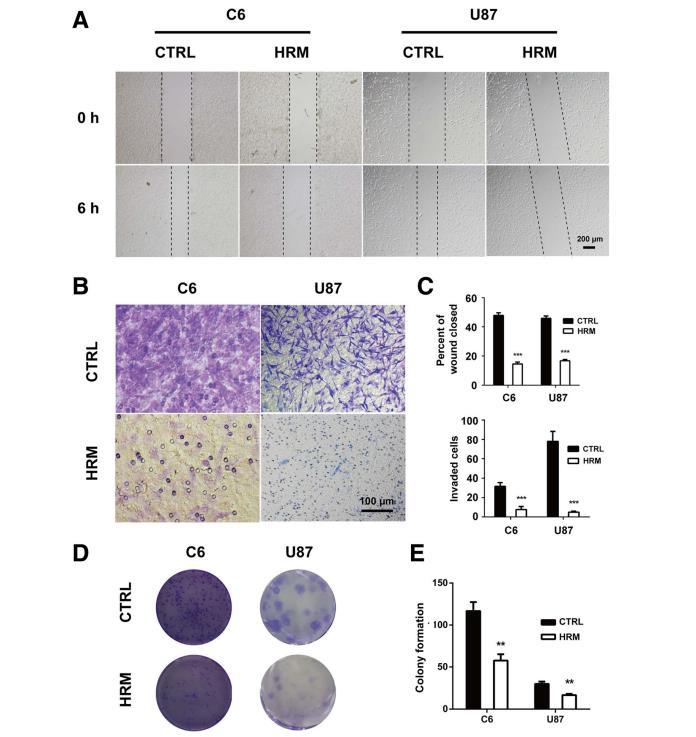
圖5氫處理抑制了C6和U87細(xì)胞的遷移、侵襲和集落形成能力。氫氣處理后使用傷口愈合試驗(yàn)檢測細(xì)胞遷移能力(a)。氫氣處理后,使用Matrigel侵襲試驗(yàn)測定細(xì)胞的侵襲能力(b)。遷移和侵襲試驗(yàn)的定量代表三個(gè)獨(dú)立實(shí)驗(yàn)(c)。氫氣處理后使用集落形成試驗(yàn)評(píng)估集落形成能力(d)。菌落形成檢測的定量代表三個(gè)獨(dú)立實(shí)驗(yàn)(e)。
為了確定分子氫對膠質(zhì)瘤細(xì)胞遷移的潛在影響,我們采用了體外創(chuàng)傷試驗(yàn)。如圖5a和c所示,氫處理明顯降低了C6細(xì)胞(14.47±0.72vs.47.83±1.05,p<0.0001)和U87細(xì)胞(12.67±0.50vs.33.68±1.69,p<0.0001)的運(yùn)動(dòng)性。與此同時(shí),還進(jìn)行了Matrigel侵襲試驗(yàn),以確定氫處理對膠質(zhì)瘤細(xì)胞侵襲的影響。如圖5b和c所示,分子氫顯著抑制了C6的細(xì)胞侵襲性(24.83±1.30vs.33.98±0.52,p<0.0001)和U87細(xì)胞(24.83±1.30vs.33.98±0.52,p=0.0005)。
為了確定氫處理對膠質(zhì)瘤細(xì)胞集落形成能力的影響,進(jìn)行了集落形成試驗(yàn)。在C6和U87細(xì)胞中,與對照組相比,氫處理組的集落形成細(xì)胞數(shù)明顯減少(C6,57.67±4.37vs.116.70±6.12,p=0.0014;U87,16.67±0.88vs.30.00±1.53,p=0.0016)(圖5d、e)。
討論:
分子氫對多種腫瘤的影響已有報(bào)道,包括皮膚鱗狀細(xì)胞癌、肺癌、卵巢癌、胸腺淋巴瘤、肝臟腫瘤、腎細(xì)胞癌和結(jié)腸癌。然而,分子氫是否對GBM有抗腫瘤作用仍是未知數(shù)。在本研究中,我們首次提供了氫氣處理可對GBM細(xì)胞產(chǎn)生抗腫瘤作用的證據(jù)。利用大鼠正位膠質(zhì)瘤模型和小鼠皮下異種移植模型,我們證明了吸入氫氣可以有效抑制GBM腫瘤的生長,延長GBM小鼠的生存期。IHC檢測進(jìn)一步證實(shí)了這一點(diǎn),氫氣處理抑制了增殖標(biāo)記物Ki67和血管生成標(biāo)記物CD34的表達(dá)。IHC染色也顯示,干性標(biāo)記物的表達(dá)在吸入氫氣后明顯減少。體外細(xì)胞研究進(jìn)一步證實(shí)了這一點(diǎn)。氫氣處理可抑制膠質(zhì)瘤細(xì)胞在體外的遷移、侵襲和集落形成。
GBM的預(yù)后很差,至少部分原因是無法成功通過血腦屏障(BBB)給藥。由于氫氣分子小且無極性,它可以輕松穿過血腦屏障。氫氣的這一特性及其生物學(xué)益處使其成為治療GBM的理想候選物質(zhì)。值得注意的是,我們的體內(nèi)研究使用了67%的氫氣和33%的氧氣。氫氣和氧氣的濃度遠(yuǎn)遠(yuǎn)高于之前大多數(shù)研究中使用的濃度(≈1-4%H2和21%O2)。雖然低濃度分子氫在多種疾病中的作用已被廣泛報(bào)道,但也有一些研究使用了高濃度分子氫,同樣具有抗腫瘤作用。綜上所述,這些研究可能表明,高濃度分子氫對治療癌癥可能更有效,但分子氫的劑量-反應(yīng)關(guān)系還需要進(jìn)一步研究。
膠質(zhì)瘤干樣細(xì)胞(GSCs)是膠質(zhì)瘤腫瘤細(xì)胞中罕見的亞群,具有無限增殖、自我更新和多能分化的能力。這些細(xì)胞負(fù)責(zé)膠質(zhì)瘤的起始、侵襲性、耐藥性和隨后的復(fù)發(fā),因此被認(rèn)為是治療GBM的重要靶點(diǎn)。在本研究中,我們首次證明氫氣處理可誘導(dǎo)GSCs分化。體內(nèi)和體外研究均表明,氫氣處理可減輕膠質(zhì)瘤細(xì)胞的干性,這表現(xiàn)在干性標(biāo)志物(CD133和Nestin)的表達(dá)減少和膠質(zhì)標(biāo)志物GFAP的表達(dá)增強(qiáng)。氫處理還抑制了成球能力。為了直接評(píng)估氫處理對GSC分化的影響,我們檢查了C6亞球細(xì)胞。結(jié)果表明,氫處理可升高GFAP的表達(dá),下調(diào)CD133的表達(dá)。流式細(xì)胞術(shù)分析也顯示,氫處理的C6亞球中CD133陽性細(xì)胞數(shù)量減少。
先前的一項(xiàng)研究表明,將干細(xì)胞暴露于血清可誘導(dǎo)線粒體活性氧(ROS)以及氧化應(yīng)激反應(yīng),導(dǎo)致干細(xì)胞出現(xiàn)分化形態(tài)并下調(diào)干性標(biāo)志物。在一些實(shí)驗(yàn)系統(tǒng)中,ROS也可誘導(dǎo)干細(xì)胞正常分化。因此,作為一種抗氧化劑,分子氫能誘導(dǎo)GSC分化似乎是自相矛盾的。以往的研究表明,分子氫可選擇性地清除具有高度細(xì)胞毒性的羥自由基;然而,這種解釋并不能充分解釋分子氫的多種作用。例如,川崎等人報(bào)告說,雖然分子氫不能減少間充質(zhì)干細(xì)胞(MSCs)中的羥自由基,但卻能有效延長骨髓的體外復(fù)制壽命,而不會(huì)喪失分化潛能。耐人尋味的是,也有報(bào)道稱分子氫可通過輕度誘導(dǎo)線粒體超氧化物的產(chǎn)生而起到絲裂激素的作用。也許氫誘導(dǎo)的ROS促進(jìn)了GSCs的分化和干性下調(diào)。然而,確切的內(nèi)在機(jī)制還需要進(jìn)一步研究。
我們還研究了分子氫對GBM細(xì)胞遷移、侵襲和集落形成能力的影響。結(jié)果顯示,氫處理抑制了C6和U87細(xì)胞的遷移、侵襲和集落形成能力。我們之前對卵巢癌細(xì)胞的研究也報(bào)道了類似的效果。GBM的一個(gè)特征是腫瘤細(xì)胞廣泛侵入正常腦組織并沿血管徑向擴(kuò)散,導(dǎo)致無法完全切除所有惡性細(xì)胞。包括化療和放療在內(nèi)的一線細(xì)胞毒療法對阻止GBM的侵襲基本無效。因此,分子氫對膠質(zhì)瘤細(xì)胞遷移和侵襲的抑制作用使其極有希望成為一種潛在的治療GBM的候選藥物,無論是單獨(dú)使用還是與其他抗癌療法聯(lián)合使用。
結(jié)論:
本研究表明,吸入67%的氫氣對GBM有抑制作用。體內(nèi)和體外研究均表明,分子氫能誘導(dǎo)GSCs理想的分化。此外,分子氫還能抑制GBM細(xì)胞的遷移、侵襲和集落形成能力。因此,我們的研究結(jié)果表明,分子氫可能是一種治療GBM的潛在抗腫瘤藥物。有關(guān)其機(jī)制的進(jìn)一步研究和臨床調(diào)查非常有必要。
 相關(guān)新聞
相關(guān)新聞