熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Ability of prebiotic polysaccharides to activate a HIF1α-antimicrobial peptide axis determines liver injury risk in zebrafish
生命起源以前的多糖激活HIF1α-antimicrobial肽軸的能力決定了斑馬魚肝損傷的風(fēng)險
來源:COMMUNICATIONS BIOLOGY | (2019) 2:274
摘要概括
本研究深入探究了不同來源的細(xì)菌胞外多糖(EPS) 在改善高脂飲食誘導(dǎo)的斑馬魚肝臟脂肪變性(hepatic steatosis)時,所表現(xiàn)出的截然不同的安全性。盡管來自鼠李糖乳桿菌GG(LGG EPS) 和干酪乳桿菌BL23(BL23 EPS) 的多糖都能有效減少肝臟脂肪堆積,但只有BL23 EPS會引發(fā)肝臟炎癥和損傷。機制研究表明,這種差異源于兩者對腸道菌群的不同調(diào)控:BL23 EPS導(dǎo)致菌群失調(diào)(dysbiosis),而LGG EPS促進菌群穩(wěn)態(tài)(homeostasis)。核心發(fā)現(xiàn)是,LGG EPS能直接激活腸道上皮細(xì)胞中的缺氧誘導(dǎo)因子HIF1α,進而上調(diào)抗菌肽(AMPs)的表達,后者是維持腸道微生物平衡的關(guān)鍵效應(yīng)分子。而BL23 EPS缺乏此功能。最終,研究指出,一種益生元多糖是否存在肝臟損傷風(fēng)險,取決于其激活HIF1α-抗菌肽軸的效率,這一結(jié)論也適用于其他多種常見天然多糖。
研究目的
本研究旨在回答兩個核心問題:
為何兩種同為乳酸菌來源的益生元多糖(LGG EPS 和 BL23 EPS)在改善脂肪肝的同時,卻具有截然不同的肝臟安全性(一個護肝,一個傷肝)?
其背后的分子機制和微生物學(xué)機制是什么?能否找到一個普適性的生物學(xué)指標(biāo)來預(yù)測和評估其他益生元多糖的潛在風(fēng)險?
研究思路
研究團隊采用了從“現(xiàn)象”到“機制”的層層遞進策略:
表型確認(rèn):首先在高脂飲食喂養(yǎng)的斑馬魚(成年和幼魚)模型中,確認(rèn)LGG EPS和BL23 EPS在減輕肝臟脂肪變性和誘導(dǎo)肝臟損傷上的不同表型。
機制探索:
微生物組作用:通過無菌斑馬魚實驗、抗生素清除菌群實驗和菌群移植實驗,證明BL23 EPS的肝損傷效應(yīng)依賴于其誘導(dǎo)的腸道菌群失調(diào),而非多糖本身直接毒性。
宿主通路挖掘:通過對比分析,發(fā)現(xiàn)LGG EPS能特異性地激活腸道HIF1α信號通路并上調(diào)抗菌肽表達,而BL23 EPS則不能。
因果驗證:使用HIF1α抑制劑(YC-1) 處理LGG EPS組,以及利用HIF1α活性先天增強的突變斑馬魚(foxo3b-/-) 處理BL23 EPS組,反向驗證HIF1α-抗菌肽軸是決定菌群穩(wěn)態(tài)和肝臟安全性的關(guān)鍵樞紐。
結(jié)構(gòu)-功能關(guān)系:通過酶解處理去除LGG EPS的側(cè)鏈,證明其主鏈結(jié)構(gòu)是與宿主受體(TLR4ba)互作并激活HIF1α的關(guān)鍵。
普適性驗證:將研究結(jié)論推廣至其他9種常見天然多糖,驗證其肝臟安全性風(fēng)險與激活HIF1α的效率直接相關(guān)。
測量數(shù)據(jù)及其研究意義
肝臟脂肪變性與損傷指標(biāo)
數(shù)據(jù)來源:圖2a-d 通過油紅O染色和甘油三酯(TAG)含量測定展示肝臟脂肪堆積;圖3a-b 通過血清ALT/AST水平評估肝損傷。


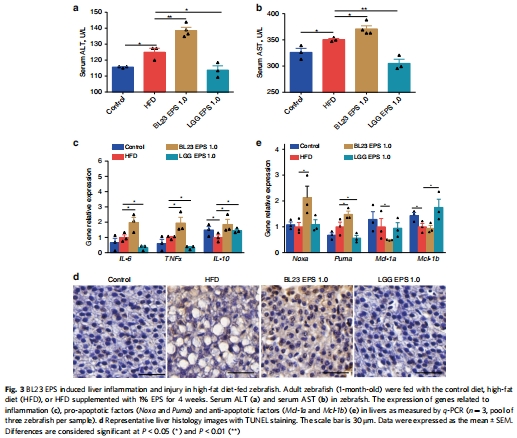
研究意義:這些數(shù)據(jù)直觀證實了核心表型——兩者都減脂,但只有BL23 EPS傷肝。為后續(xù)的機制研究提供了明確的出發(fā)點。
腸道微生物組分析
數(shù)據(jù)來源:圖4d 通過16S rRNA測序展示門水平菌群組成;Supplementary Fig. 3 提供了更詳細(xì)的菌群分析(如Beta多樣性、關(guān)鍵菌屬)。
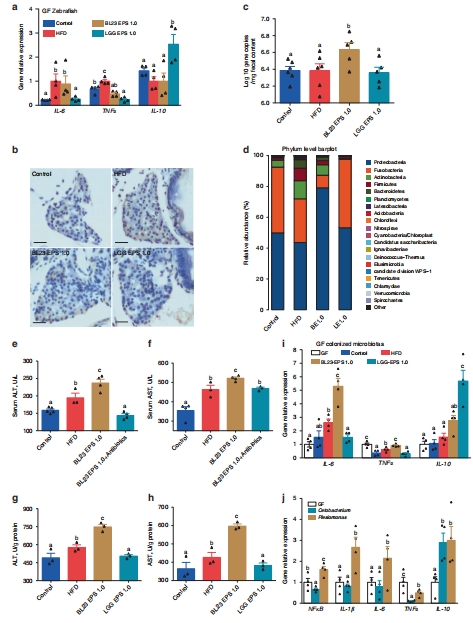

研究意義:數(shù)據(jù)顯示BL23 EPS導(dǎo)致變形菌門(Proteobacteria,含許多潛在致病菌)富集和 Fusobacteria門(含有益菌Cetobacterium)減少,而LGG EPS作用相反。這直接將肝損傷與特定的菌群失調(diào)模式聯(lián)系起來。
HIF1α與抗菌肽(AMP)表達
數(shù)據(jù)來源:圖7a-c 通過qPCR和Western Blot證明LGG EPS特異性激活HIF1α;圖6i 和 圖7i 顯示LGG EPS組抗菌肽表達顯著升高。
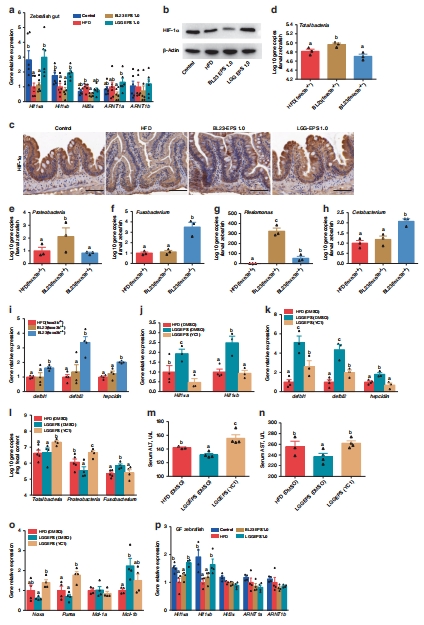

研究意義:這是本研究的核心發(fā)現(xiàn)。數(shù)據(jù)證明了LGG EPS通過一條獨特的宿主通路(HIF1α-AMP軸) 來主動維持菌群穩(wěn)態(tài),從而解釋了為何兩種多糖會導(dǎo)致不同的菌群結(jié)局。
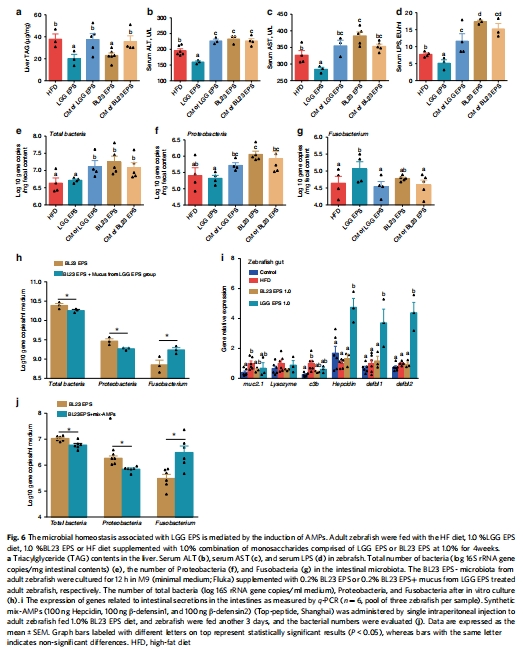
菌群移植與抗菌肽回補實驗
數(shù)據(jù)來源:圖4g-i 的菌群移植實驗;圖6j 的合成抗菌肽注射實驗。
研究意義:這些功能獲得/喪失實驗提供了最直接的因果證據(jù)。將BL23 EPS組的菌群移植給無菌魚,會重現(xiàn)肝損傷;而給BL23 EPS組魚注射抗菌肽,能逆轉(zhuǎn)其菌群失調(diào)。這強有力地證明菌群是傷肝的直接執(zhí)行者,而抗菌肽是維持穩(wěn)態(tài)的關(guān)鍵效應(yīng)分子。
短鏈脂肪酸(SCFA)與腸道氧氣濃度
數(shù)據(jù)來源:圖9a-d 測量了腸道內(nèi)容物中的SCFA含量;圖9e-f 和 Supplementary Fig. 4e-h 使用丹麥Unisense微電極測量腸道黏膜氧氣濃度。
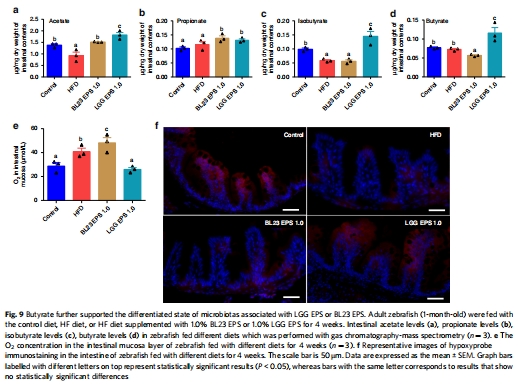
研究意義:SCFA數(shù)據(jù)表明LGG EPS組產(chǎn)生了更多的丁酸鹽(butyrate),而丁酸鹽已知能降低腸道局部氧分壓。Unisense電極的測量結(jié)果直接證實了這一點:LGG EPS組腸道氧濃度更低。低氧環(huán)境有利于穩(wěn)定HIF1α蛋白并抑制需氧的變形菌生長,這形成了一個積極的反饋循環(huán),進一步強化了LGG EPS的益生作用。
多糖普適性風(fēng)險驗證
數(shù)據(jù)來源:圖10a-b 測試了9種其他多糖激活HIF1α的能力及其對應(yīng)的肝損傷指標(biāo)(血清AST)。
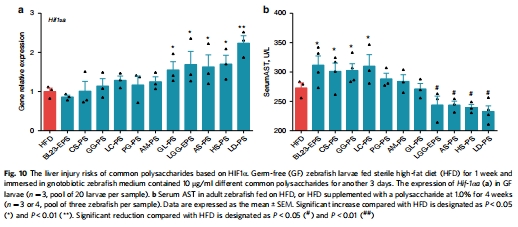
研究意義:將發(fā)現(xiàn)從一個特例提升到一個普適性規(guī)律:能否有效激活腸道HIF1α,是預(yù)測一種益生元多糖是否存在肝臟損傷風(fēng)險的可靠生物學(xué)指標(biāo)。
研究結(jié)論
本研究得出以下核心結(jié)論:
益生元多糖在改善脂肪肝時存在潛在風(fēng)險,其安全性并非由減脂效果決定,而是取決于其對腸道微生態(tài)的影響。
HIF1α-抗菌肽軸是宿主調(diào)控腸道菌群穩(wěn)態(tài)的一條關(guān)鍵通路。能激活此通路的多糖(如LGG EPS)能維持健康菌群,保護肝臟;而不能激活此通路的多糖(如BL23 EPS)則可能引發(fā)菌群失調(diào),導(dǎo)致肝臟炎癥和損傷。
多糖的化學(xué)結(jié)構(gòu)決定其能否被宿主模式識別受體(如TLR4ba)識別并啟動HIF1α信號。
菌群代謝產(chǎn)物(如丁酸鹽)可通過降低腸道氧分壓來穩(wěn)定和增強HIF1α信號,形成一個有益的正反饋循環(huán)。
最終,激活HIF1α的效率可作為篩選和評估益生元多糖安全性的一個重要分子標(biāo)志。
丹麥Unisense電極測量數(shù)據(jù)的詳細(xì)解讀
在本研究中,使用丹麥Unisense微電極對斑馬魚腸道黏膜氧氣濃度(pO?) 的原位測量數(shù)據(jù)(圖9e-f 和 Supplementary Fig. 4e-h)具有至關(guān)重要的作用,其研究意義遠(yuǎn)超簡單的環(huán)境監(jiān)測:
提供了連接“菌群功能”與“宿主生理”的關(guān)鍵橋梁數(shù)據(jù):本研究提出了一個重要的假設(shè):LGG EPS組菌群產(chǎn)生更多丁酸鹽,而丁酸鹽能降低腸道氧分壓,從而穩(wěn)定HIF1α并創(chuàng)造不利于有害菌生長的環(huán)境。Unisense電極的原位、實時、高空間分辨率測量,直接證實了LGG EPS組斑馬魚腸道內(nèi)的氧氣濃度顯著低于BL23 EPS組和HFD組。這組定量數(shù)據(jù)為整個“丁酸鹽→低氧→HIF1α穩(wěn)定→菌群穩(wěn)態(tài)”的假設(shè)鏈條提供了最堅實的實證支持,使其從推測變?yōu)榭尚诺慕Y(jié)論。
其高空間分辨率揭示了微環(huán)境異質(zhì)性對菌群分布的決定性影響:Unisense微電極的尖端極其微小,可以精確地插入腸道組織中進行測量,能夠解析從腸腔中心到腸壁黏膜的氧氣梯度。這種高空間分辨率使得研究人員能夠?qū)⑽⑸锏纳鷳B(tài)位(如需氧菌、兼性厭氧菌、嚴(yán)格厭氧菌) 與具體的物理化學(xué)環(huán)境聯(lián)系起來。數(shù)據(jù)顯示LGG EPS組黏膜層氧分壓更低,這合理解釋了為何有益菌(如Fusobacteria中的Cetobacterium,多為厭氧菌)能在該環(huán)境下茁壯成長,而潛在有害菌(如Proteobacteria中的Plesiomonas,多為兼性需氧菌)受到抑制。這從微生態(tài)學(xué)角度深刻闡釋了菌群結(jié)構(gòu)差異的成因。
從機制上解釋了HIF1α蛋白穩(wěn)定性差異的原因:HIF1α的活性受氧濃度調(diào)控,在低氧環(huán)境下穩(wěn)定存在。Unisense電極測得的低氧數(shù)據(jù),為LGG EPS組中HIF1α蛋白水平更高(圖7b-c)提供了一個直接的環(huán)境機制解釋——不僅是轉(zhuǎn)錄激活,還有翻譯后水平的蛋白穩(wěn)定。這使得HIF1α-AMP軸的激活機制更加完整和具有說服力。
技術(shù)可靠性確保了實驗結(jié)論的準(zhǔn)確性:Unisense微傳感器以其高精度和快速響應(yīng)時間著稱。在研究前,電極經(jīng)過嚴(yán)格的校準(zhǔn)(在飽和空氣和零氧溶液中進行),確保了所測電流信號與氧氣分壓之間的換算準(zhǔn)確無誤。這種專業(yè)測量技術(shù)保障了數(shù)據(jù)的高質(zhì)量和可靠性,使得基于此數(shù)據(jù)得出的所有后續(xù)推論都建立在堅實的基礎(chǔ)上。
綜上所述,丹麥Unisense微電極在本研究中絕非一個簡單的輔助工具,它是驗證“代謝物-微環(huán)境-宿主信號-菌群結(jié)構(gòu)”這一復(fù)雜互作網(wǎng)絡(luò)的核心技術(shù)。它提供的原位、定量、高分辨率的氧氣數(shù)據(jù),成功地將抽象的“腸道微環(huán)境”概念轉(zhuǎn)化為具體且可測量的科學(xué)參數(shù),并令人信服地揭示了物理化學(xué)環(huán)境如何作為關(guān)鍵因素,最終決定菌群的組成和宿主肝臟的健康結(jié)局。沒有這組數(shù)據(jù),該研究的機制闡釋將缺乏一個關(guān)鍵的中間環(huán)節(jié),其深度和說服力會大打折扣。