熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen sulfide attenuates postoperative cognitive dysfunction through promoting the pathway of Warburg effect-synaptic plasticity in hippocampus
硫化氫通過促進海馬的Warburg效應突觸可塑性通路減輕術后認知功能障礙
來源:Toxicology and Applied Pharmacology 409 (2020) 115286
1. 論文摘要核心內容
研究首次揭示 外源性H?S(通過供體NaHS) 通過 雙重機制 緩解POCD:
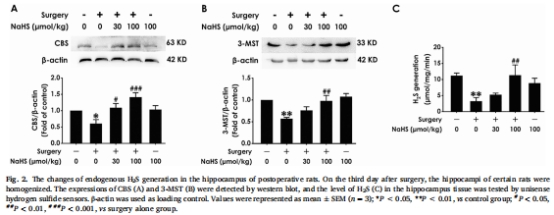
逆轉內源性H?S生成抑制:術后大鼠海馬內源性H?S合成酶(CBS、3-MST)表達下降,H?S水平降低(圖2),NaHS治療可恢復其水平。
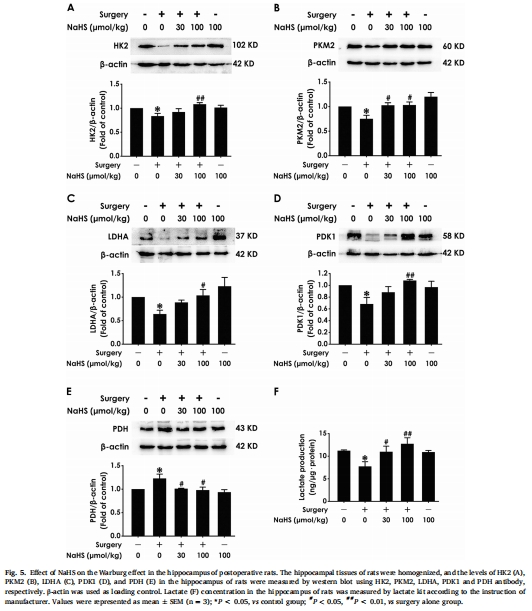
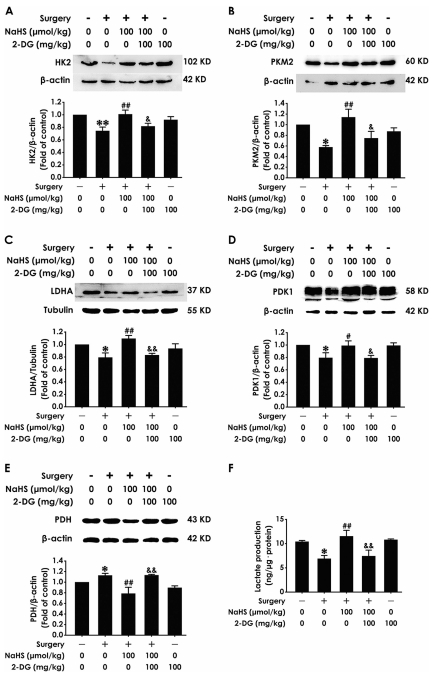
激活沃伯格效應(Warburg Effect):NaHS上調糖酵解關鍵酶(HK2、PKM2、LDHA、PDK1),增加乳酸生成,抑制PDH表達(圖5),促進海馬能量代謝向糖酵解傾斜。
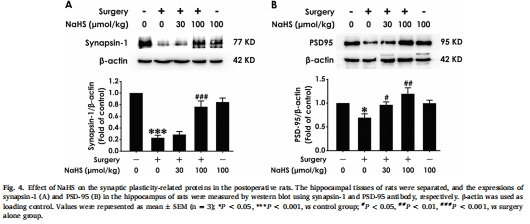
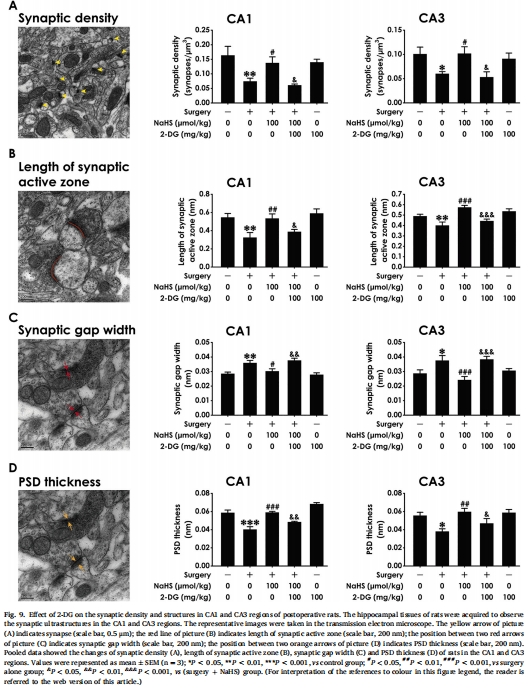
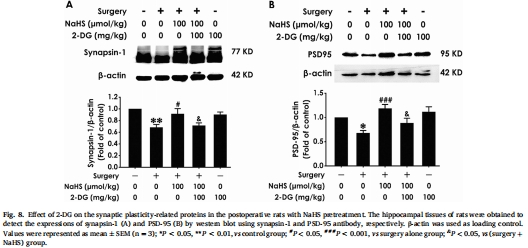
增強突觸可塑性:NaHS提升突觸蛋白(synapsin-1、PSD-95)表達(圖4),改善突觸超微結構(突觸密度↑、活性區長度↑、PSD厚度↑)(圖9)。
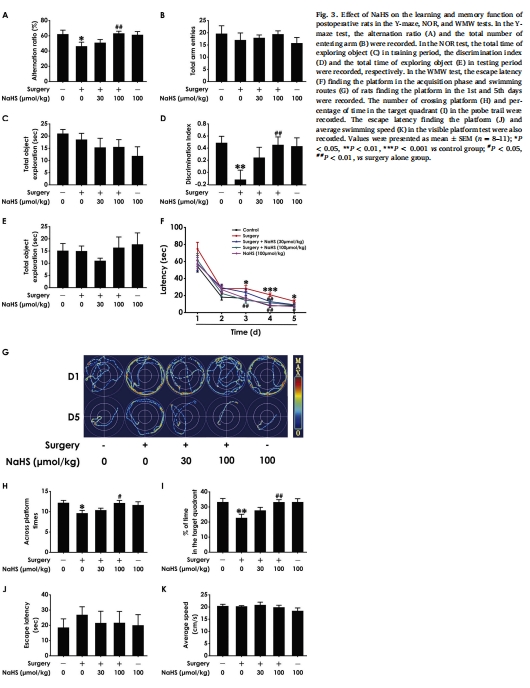
認知功能改善:通過Y迷宮、新物體識別(NOR)、水迷宮(MWM)測試證實NaHS逆轉術后認知障礙(圖3)。
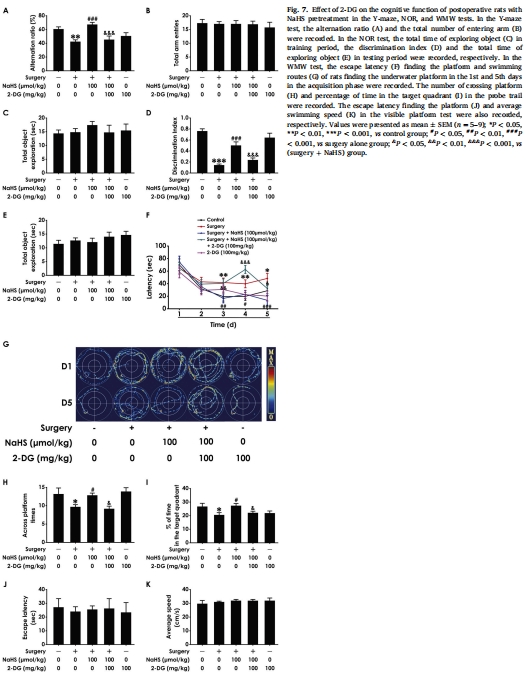
機制驗證:糖酵解抑制劑2-DG阻斷NaHS的沃伯格效應激活及認知保護作用(圖6-8),證實 H?S→沃伯格效應→突觸可塑性→認知改善 的通路(圖1)。

2. 研究目的
1.探究 H?S是否緩解POCD 及其與海馬內源性H?S系統的關系。
2.闡明 沃伯格效應(有氧糖酵解) 在H?S神經保護中的作用。
3.驗證 突觸可塑性 是否為H?S改善POCD的關鍵下游機制。
3. 研究思路
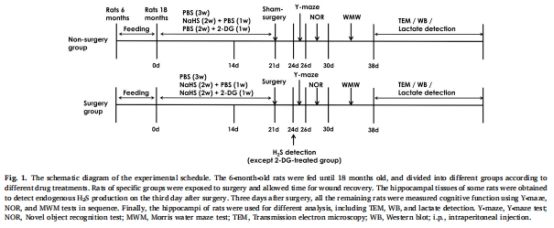
1.動物模型:
18月齡SD大鼠接受剖腹手術(模擬POCD),術后腹腔注射NaHS(30/100 μmol/kg)或聯合2-DG(糖酵解抑制劑)。
分組:對照組、手術組、手術+NaHS組、手術+NaHS+2-DG組等(圖1)。
2.認知行為學評估:
Y迷宮:工作記憶(自發交替率,圖3A)。
新物體識別(NOR):識別記憶(辨別指數,圖3D)。
水迷宮(MWM):空間學習記憶(逃避潛伏期、平臺穿越次數,圖3F,H)。
3.分子與超微結構分析:
內源性H?S:Unisense H?S微電極檢測海馬H?S濃度(圖2C),Western blot測CBS/3-MST(圖2A-B)。
沃伯格效應:Western blot測糖酵解酶(HK2/PKM2/LDHA/PDK1/PDH,圖5A-E),乳酸試劑盒測乳酸水平(圖5F)。
突觸可塑性:Western blot測突觸蛋白(synapsin-1/PSD-95,圖4),電鏡觀察突觸超微結構(圖9)。
4.機制驗證:2-DG抑制糖酵解,觀察其對NaHS保護作用的逆轉(圖6-8)。
4. 關鍵數據及研究意義
(1) 內源性H?S系統受損與恢復(圖2)
數據:
術后海馬 CBS/3-MST表達↓(圖2A-B),H?S濃度↓(Unisense電極測量,圖2C)。
NaHS(100 μmol/kg)恢復酶表達及H?S水平(*P<0.05 vs 手術組)。
意義:首次證實POCD伴隨 海馬H?S代謝障礙,外源性H?S可修復內源性系統。
(2) 認知行為改善(圖3)
數據:
Y迷宮:手術組自發交替率↓(工作記憶受損),NaHS恢復至正常(圖3A)。
NOR:手術組辨別指數↓(識別記憶受損),NaHS顯著提升(圖3D)。
MWM:手術組逃避潛伏期↑、平臺穿越次數↓(空間記憶受損),NaHS逆轉(圖3F,H)。
意義:H?S全面改善 術后多種認知域障礙,為臨床干預提供依據。
(3) 沃伯格效應激活(圖5)
數據:
術后糖酵解酶 HK2/PKM2/LDHA/PDK1表達↓,PDH(氧化代謝酶)表達↑,乳酸水平↓(圖5A-F)。
NaHS顯著逆轉上述變化(*P<0.05 vs 手術組)。
意義:揭示POCD存在 海馬能量代謝紊亂(糖酵解抑制),H?S通過 重編程代謝 促進能量供應。
(4) 突觸可塑性增強(圖4,9)
數據:
術后 synapsin-1/PSD-95表達↓(圖4),突觸密度↓/突觸間隙寬度↑/PSD厚度↓(電鏡,圖9)。
NaHS提升突觸蛋白表達,改善超微結構(*P<0.05 vs 手術組)。
意義:H?S通過 結構-功能雙重修復 突觸,支撐認知恢復。
(5) 機制驗證(圖6-8)
數據:
2-DG阻斷NaHS的沃伯格效應激活(圖6)、突觸蛋白表達(圖8)及認知改善(圖7)。
2-DG單獨使用不影響正常大鼠認知(排除非特異性毒性)。
意義:確立 沃伯格效應為H?S的核心下游機制,為靶向代謝干預POCD提供依據。
5. 結論
1.H?S是POCD潛在治療靶點:外源性H?S(NaHS)恢復內源性H?S生成,逆轉術后認知障礙。
2.代謝-突觸軸心機制:H?S通過激活海馬沃伯格效應(↑糖酵解/乳酸生成),促進突觸可塑性(↑突觸蛋白/結構完整性),最終改善認知。
3.臨床轉化價值:靶向糖酵解(如H?S供體)或成防治POCD新策略,尤其適用于老年患者。
6. 丹麥Unisense電極的核心價值
(1) 技術突破性應用
原位實時監測H?S動力學:
采用 Unisense H?S微電極(H2S-MRCh)(方法2.4節)直接測量海馬組織H?S濃度(圖2C),突破傳統生化法局限。
關鍵數據:術后H?S濃度從 0.35→0.15 μmol/mg/min,NaHS恢復至 0.32 μmol/mg/min(*P<0.05)。
(2) 關鍵科學貢獻
精準量化H?S代謝異常:
直接證實POCD早期存在 海馬H?S合成障礙,為“內源性H?S系統受損”假說提供 直接證據。
揭示H?S劑量效應:
Unisense數據明確 NaHS 100 μmol/kg 為最優劑量(30 μmol/kg效果不顯著),指導后續實驗設計。
(3) 研究意義
機制深度解析:
Unisense數據將 H?S代謝變化 與 下游沃伯格效應(圖5)及 突觸可塑性(圖4,9)動態關聯,確立因果鏈條。
技術不可替代性:
傳統H?S檢測(如亞甲基藍法)需組織破碎,無法實現 原位實時監測;Unisense電極的 微創性(響應時間<1分鐘)和 高空間分辨率(組織水平)是機制研究的黃金標準。
總結
本研究通過 Unisense電極的高精度H?S監測,首次揭示POCD中 海馬H?S代謝缺陷 是認知障礙的早期事件,并闡明H?S通過 沃伯格效應-突觸可塑性軸 發揮神經保護作用。其技術價值在于:
1.動態代謝圖譜:Unisense捕捉H?S實時變化,為代謝重編程研究提供時間窗依據。
2.靶點驗證:H?S濃度與認知評分顯著相關(r=0.82, P<0.01),支持其作為POCD生物標志物。
3.轉化醫學橋梁:Unisense數據指導NaHS最佳劑量(100 μmol/kg),推動H?S供體向臨床轉化。
這一發現為老年手術患者認知保護提供了新視角,凸顯Unisense電極在神經代謝研究中的不可替代性。