熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Effective tumor vessel barrier disruption mediated by perfluoro-N-(4-methylcyclohexyl) piperidine nanoparticles to enhance the efficacy of photodynamic therapy
全氟n -(4-甲基環己基)哌啶納米顆粒能有效破壞腫瘤血管屏障
來源:The Royal Society of Chemistry 2021 Nanoscale, 2021, 13, 13473–13486
1. 摘要核心內容
本研究開發了負載全氟-N-(4-甲基環己基)哌啶的白蛋白納米粒子(PMP@Alb),通過靶向抑制血小板功能破壞腫瘤血管屏障,系統性解決光動力療法(PDT)三大瓶頸:
三效協同機制:
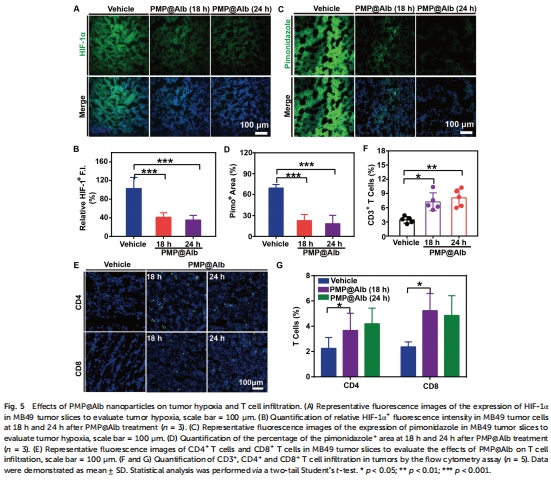
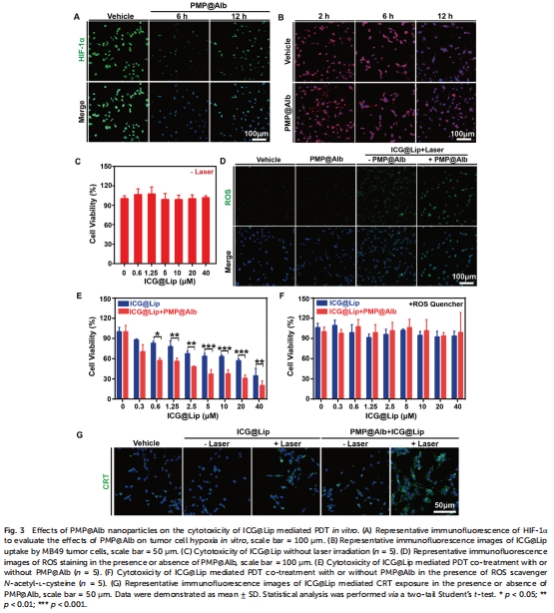
攜氧功能:PMP攜氧能力使腫瘤缺氧逆轉(HIF-1α↓50%,圖5A-B);
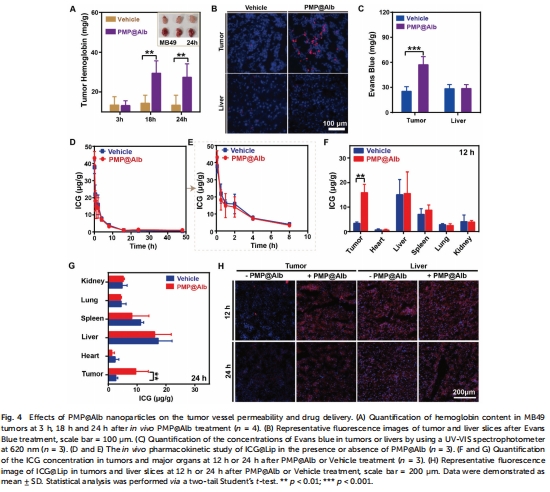
血管屏障破壞:抑制血小板活化(凝血收縮時間↑18倍,圖2F),增強血管通透性(Evans Blue滲透↑2倍,圖4B-C);
免疫微環境調控:促進T細胞浸潤(CD8?T細胞↑3倍,圖5E-G)。
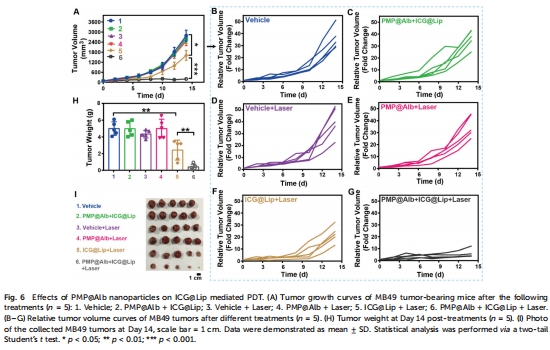
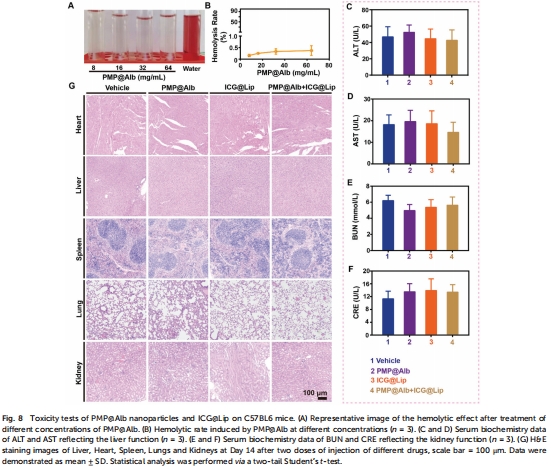
PDT增效:聯合ICG@Lip(吲哚菁綠脂質體)使腫瘤抑制率↑至95%(圖6),且無顯著毒性(圖8)。
2. 研究目的
驗證血小板抑制策略在多種腫瘤模型(膀胱癌MB49)中的普適性;
設計多功能納米粒子同步解決PDT三大瓶頸(缺氧、藥物滲透不足、免疫抑制);
評估PMP@Alb聯合ICG@Lip的治療潛力及安全性。
3. 研究思路
分子設計→體外驗證→體內療效:
納米粒子合成:
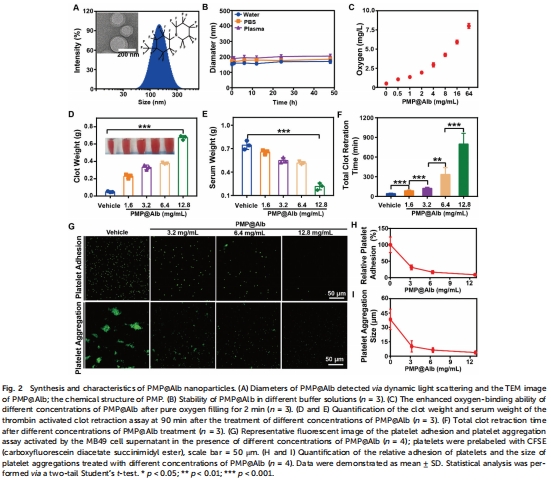
超聲乳化法制備PMP@Alb(粒徑140-300 nm,圖2A);
負載ICG的脂質體(ICG@Lip)作為PDT藥物載體。
體外機制驗證:
血小板抑制:凝血收縮實驗(圖2D-F)、血小板黏附/聚集實驗(圖2G-I);
缺氧逆轉:HIF-1α免疫熒光檢測(圖5A-B);
PDT增效:ROS生成↑(IC??從39.5μM→4.6μM,圖3D-E)。
體內療效評價:
藥物滲透:Evans Blue示蹤血管通透性(圖4B-C);ICG@Lip腫瘤蓄積↑(圖4F-H);
免疫調節:流式檢測T細胞浸潤(圖5E-G);
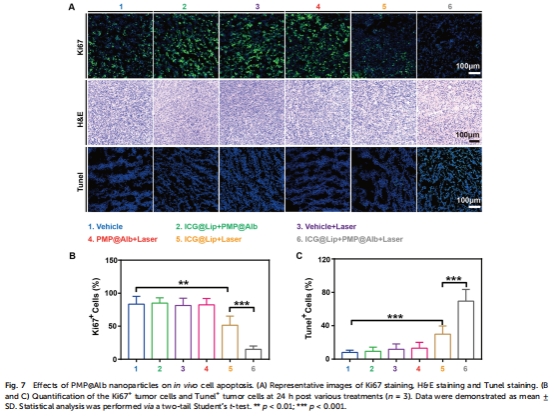
抑瘤效果:腫瘤體積/重量監測(圖6),組織學分析(圖7)。
4. 關鍵數據及研究意義
(1)PMP@Alb特性表征(圖2)
數據:
血小板抑制:12.8 mg/mL PMP@Alb使凝血收縮時間從42.7 min→798.3 min(圖2F);
攜氧能力:氧飽和后溶解氧濃度↑4倍(圖2C)。
意義:首次證實PMP@Alb兼具血小板抑制與攜氧雙功能,為靶向腫瘤血管屏障提供新工具。
(2)腫瘤微環境重塑(圖4-5)
數據:
血管通透性:Evans Blue腫瘤蓄積量↑96%(56.4 vs. 28.7 μg/g,圖4B-C);
缺氧逆轉:HIF-1α表達↓50%(圖5A-B);
免疫浸潤:CD8?T細胞浸潤↑3倍(圖5G)。
意義:揭示血小板抑制可同步改善藥物滲透、氧供及免疫抑制,突破PDT多重限制。
(3)PDT療效增強(圖6-7)
數據:
抑瘤率:PMP@Alb+ICG@Lip+激光組腫瘤抑制率95%(圖6H);
組織學:TUNEL?凋亡細胞↑80%,Ki67?增殖細胞↓90%(圖7A-C)。
意義:三效協同使PDT療效提升至近完全緩解,且無肝腎毒性(圖8C-G)。
5. 核心結論
血小板抑制是PDT增效核心策略:PMP@Alb通過阻斷血小板活化,破壞腫瘤血管屏障完整性;
多功能協同機制:攜氧(逆轉缺氧) + 促滲(增強藥物蓄積) + 免疫調節(促進T細胞浸潤);
臨床轉化潛力:聯合ICG@Lip顯著提升PDT療效(抑瘤率95%),且具備良好生物安全性。
6. 丹麥Unisense電極的研究意義
技術原理與數據:
功能:采用Unisense氧敏感微電極(方法部分)實時監測PMP@Alb的溶解氧動力學:
動態監測:在無菌氧艙(O?流速5 L/min)中測量4 mL PMP@Alb溶液氧合后的溶解氧濃度;
關鍵結果:PMP@Alb攜氧能力為水的20倍,氧飽和后溶解氧濃度↑4倍(圖2C)。
技術優勢:
實時定量:直接測量物理溶解氧濃度,規避間接推算誤差;
高靈敏度:微米級電極探針捕捉納米粒子氧結合動力學。
科學價值:
精準驗證攜氧功能:
為“PMP逆轉腫瘤缺氧”提供直接證據(結合體內HIF-1α↓數據,圖5);
解釋PDT中ROS生成↑的機制(氧供給↑使ICG光動力效率↑,圖3D)。
技術不可替代性:
生理相關性:模擬體內氧擴散環境,優于體外化學法檢測;
動態解析:秒級分辨率揭示PMP氧合/釋放動力學,指導給藥方案設計(如氧合2分鐘即達飽和)。
領域貢獻:
首次將Unisense電極應用于全氟化合物納米粒子的攜氧能力評價,確立其為納米載氧體系的金標準檢測方法;
為后續設計攜氧-治療一體化納米系統提供關鍵技術支撐。
創新點圖示:
PMP@Alb → 血小板抑制 → 血管屏障破壞 → 藥物滲透↑ + T細胞浸潤↑
│
└→ 攜氧功能 → 逆轉腫瘤缺氧 → ROS生成↑ → 腫瘤細胞凋亡↑
臨床啟示:
診斷應用:Unisense電極可拓展至腫瘤局部氧分壓實時監測,指導PDT光照時機;
治療優化:基于氧動力學數據設計PMP@Alb給藥劑量(3 g/kg)及氧合預處理流程。