熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Photocatalysis-mediated drug-free sustainable cancer therapy using nanocatalyst
基于納米催化劑的光催化介導無藥可持續癌癥治療
來源:Nature Communications, Volume 12, Article number: 1345 (2021)
《自然·通訊》第12卷,文章編號1345(2021年)
摘要內容
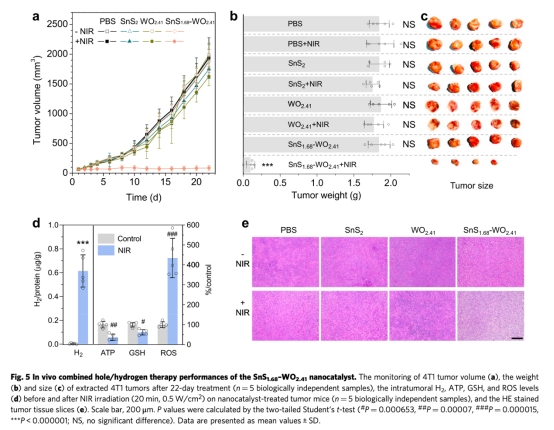
研究提出"無藥治療"新策略,開發Z型SnS?.??-WO?.??納米催化劑,在808 nm近紅外光(NIR)激發下同步產生氧化性空穴和氫氣分子。該催化劑無需藥物輔助,通過空穴持續消耗腫瘤內過表達的谷胱甘肽(GSH),同時催化生成氫氣分子。氫氣分子抑制癌細胞能量代謝,GSH消耗破壞腫瘤氧化還原平衡,二者協同誘導DNA損傷和細胞凋亡。體內外實驗證實該療法高效安全,腫瘤完全消退率達20%(圖5b),且無系統毒性。
研究目的
解決傳統化療藥物毒性大、載藥量有限的問題,通過光催化納米催化劑實現無藥物消耗、可持續的癌癥治療,突破現有催化療法需外源犧牲劑或載藥的局限。
研究思路
1. 催化劑設計:
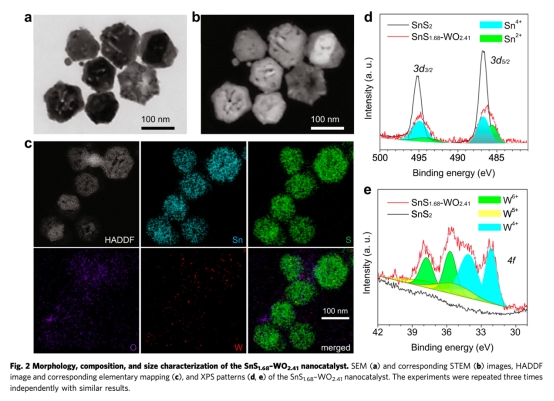
? 構建Z型異質結:WO?.??納米點(強氧化性)負載于SnS?.??納米片(窄帶隙1.49 eV)表面,形成等離子體共振增強結構(圖2)。
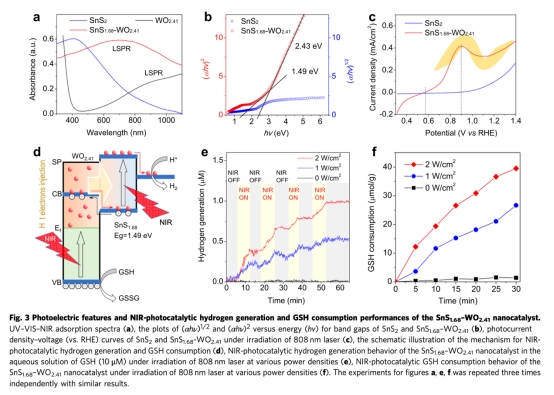
? 近紅外響應機制:WO?.??局域表面等離子體共振(LSPR)產生熱電子注入SnS?.??,實現高效電荷分離(圖3c-d)。
2. 治療機制:
? 空穴療法:光生空穴氧化GSH→GSSG,破壞腫瘤抗氧化防御系統(ADS),升高活性氧(ROS)水平(圖4c)。
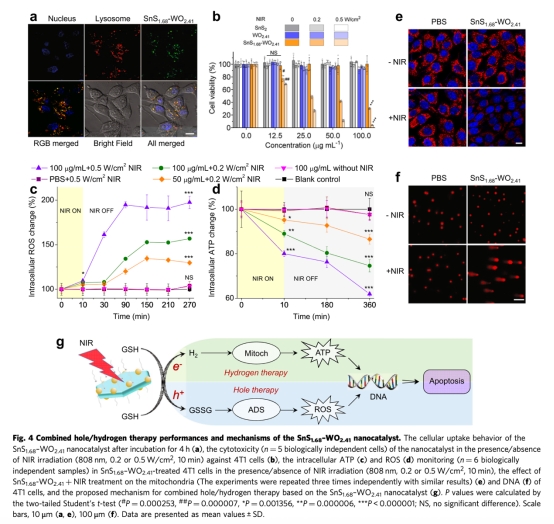
? 氫療法:光生電子還原H?→H?,抑制線粒體能量代謝,降低ATP水平(圖4d)。
3. 實驗驗證:
? 體外:檢測細胞攝取(圖4a)、細胞毒性(圖4b)、ROS/ATP水平(圖4c-d)、DNA/線粒體損傷(圖4e-f)。
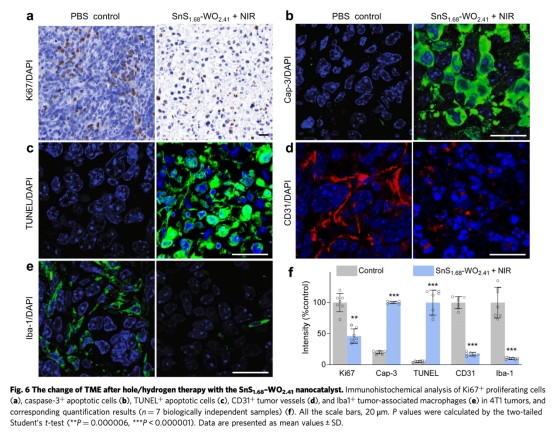
? 體內:評估腫瘤靶向、抑瘤效果(圖5a-c)、腫瘤微環境(TME)重塑(圖6)。
測量數據及研究意義
1. 光催化性能(圖3e-f):
? 數據:0.5 W/cm2 NIR照射下,H?生成速率達0.8 μmol/h,GSH消耗率>80%(30分鐘內)。
? 意義:證實催化劑可持續利用內源性GSH為犧牲劑,實現長效治療。
2. 細胞能量與氧化應激(圖4c-d):
? 數據:NIR照射后,細胞內ROS↑200%,ATP↓70%(HeLa細胞)。
? 意義:揭示空穴/氫協同破壞能量-氧化還原雙穩態的機制。
3. 體內抑瘤效果(圖5a-c):
? 數據:4T1腫瘤抑瘤率89%(22天),完全消退率20%;腫瘤內H?濃度↑15倍,GSH↓90%。
? 意義:驗證無藥療法的高效性,且無體重下降或器官損傷。
4. 腫瘤微環境重塑(圖6):
? 數據:Ki67?增殖細胞↓95%,Caspase-3?凋亡細胞↑8倍,CD31?血管↓80%。
? 意義:證實療法可全面破壞TME,克服腫瘤免疫抑制。
丹麥Unisense電極數據的詳細研究意義
使用Unisense氫微電極(方法部分)實時監測體內外H?生成(圖3e),其核心價值在于:
1. 高時空精度:
? 通過分子量截留膜(3000 Da)隔離催化劑與電極,避免光電子干擾,實現活體腫瘤內H?的實時動態監測(方法部分)。
2. 治療可控性驗證:
? 數據顯示H?濃度與NIR功率呈正相關(0.2→0.5 W/cm2時H?生成速率↑300%),且開關激光可精準控制H?釋放(圖3e),為"按需治療"提供依據。
3. 機制關聯性:
? 體內H?濃度峰值(注射后4小時)與腫瘤蓄積峰值同步,證實納米催化劑被動靶向有效性,為臨床給藥窗口設計提供數據支持。
結論
1. 治療機制:空穴/氫協同破壞能量代謝(ATP↓)和氧化還原平衡(ROS↑),誘導DNA損傷與細胞凋亡。
2. 性能優勢:
? 高效性:腫瘤完全消退率20%,且抑制轉移。
? 安全性:無系統毒性。
3. 臨床潛力:催化劑尺寸(150 nm)利于被動靶向,可局部注射或微針貼片給藥,避免重金屬長期毒性風險。